世界医疗网(上海)徐言报道 近日,港交所官网显示,维昇药业(上海)有限公司(以下简称"维昇药业")向港交所主板提交上市申请,摩根士丹利和Jefferies为其联席保荐人。这是继2022年11月17日递表失效后,维昇药业第二次冲刺IPO。

维昇药业2018年成立于上海奉贤,2022年报地址位于静安区南京西路,是一家处于后期阶段、临近商业化的生物制药公司,专注于为相关地区大量医疗需求未被满足、医疗健康政策利好的特定内分泌疾病提供创新及潜在同类最佳及/或同类首创治疗方案。
维昇药业的核心产品是一款生长激素——隆培促生长素(lonapegsomatropin)。按照其管线布局现状,维昇药业剑指前景广阔的百亿生长激素市场,势头正猛。
但是,国内生长激素市场已近乎被巨头垄断,维昇药业是否能冲出重围?其核心竞争力又如何体现?
01 License-in模式出道,5年估值超10亿美元
严格来说,维昇药业并不是中国本土诞生的企业。作为丹麦制药公司Ascendis Pharma与投资机构维梧资本、Sofinnova共同孵化的企业,维昇药业是一家典型的的License-in(授权引进)模式药企。
回顾其孵化历程,还得从2017年说起。2017年9月,时任武田制药大中华区负责人的卢安邦,毫无征兆地宣布离任,表示将寻求外部发展机会。
卢安邦,1989年6月台北医学大学药学专业毕业。毕业之后,卢安邦担任施维雅总经理,主要负责中国大陆或中国的整体发展。自2010年至2017年,先后担任武田制药总经理、总裁及大中华区总裁。
从事全球生物制药开发30多年,卢安邦成绩颇为耀眼。在武田制药任职期间,卢安邦主导了武田在中国的关键成长期。在他的领导下,武田于中国的销售收入增长10倍以上。
卢安邦的突然离任引起了同行的好奇,作为医药界老兵,卢安邦究竟又选择了哪一赛道?哪家公司?
2018年11月,卢安邦获委任为维昇药业的董事兼首席执行官,重新出现在医药行业。
维昇药业这个名字也随之映入公众视野。
成立5年,维昇药业先后获得两轮融资。2019年2月,维昇药业获得维梧资本、Sofinnova Investments、ASND下注的A轮融资。2021年1月,维昇药业完成1.5亿美元的B轮融资,其中红杉中国基金领投,奥博资本、夏尔巴、Cormorant、HBM Heal thcare Investments、鼎丰生科资本、Logos Capital、晨岭资本跟投。本轮融资后,公司估值10.3亿美元。
由此,维昇药业多次被评为独角兽。2021年,被长城战略性咨询评为中国潜在独角兽企业。同年,胡润全球独角兽榜单揭晓,维昇药业成为16家中国生物科技公司上榜企业之一。2023年,胡润研究院发布《2023全球独角兽榜》,维昇药业以69亿估值位列其中。
02 近三年累计研发超5亿元,三款产品成为国内首创
资本对于维昇药业的高度看好,根本信心来自其产品。
维昇药业目前拥有三条临床管线(均为授权引进),分别用于治疗儿童生长激素缺乏、软骨发育不全及成人甲状旁腺功能减退症。其中核心产品隆培促生长素已完成三期关键试验,预计将于今年四季度国内递交上市申请。
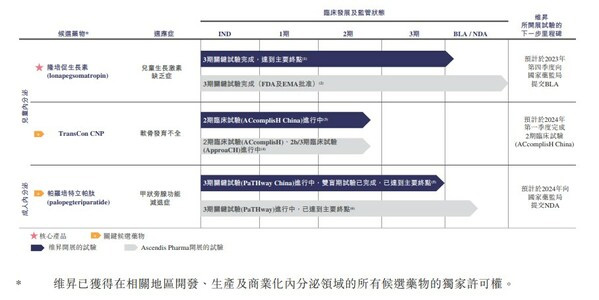
隆培促生长素是一款同类首创(First-in-Class)的长效生长激素替代疗法,用于治疗儿童生长激素缺乏症。
在介绍维昇药业这一产品之前,必须先简单了解一下我国的生长激素发展现状。
按照给药频率,生长激素疗法可以分为短效和长效两类。
短效生长激素,顾名思义效果短,需要每天给药,有粉剂和水剂两种剂型。其中短效粉剂于1998年在中国上市,是我国首类在临床使用的生长激素疗法。不过,由于短效粉剂采用标准注射器注射,注射过程复杂且会引起患者不适,因此市场接受度不高。
2005年,短效水剂在国内上市。这类剂型引进了笔式注射器,给药复杂度大大降低,因此面世后市场份额迅速增长,成为目前使用最广泛的儿童生长激素缺乏症的替代治疗药物。
然而,短效生长激素需要长期每日注射。这也就导致很多患者在进行治疗时极易出现漏针,影响治疗效果,甚至提前终止治疗。
在这种情况下,长效生长激素开始成为药企研究的新重点。维昇药业的隆培促生长素正是主攻长效生长激素的代表。隆培促生长素提供了方便的每周一次给药方案,与每日一次人生长激素相比,注射频率降低高达86%,并且显著提高了儿童患者在日常生活中给药的依从性。在实际情况中,与短效人生长激素相比,其有可能进一步改善治疗效果和延长治疗时间。
招股书显示,隆培促生长素有潜力成为用于治疗儿童生长激素缺乏症("PGHD")的同类最佳候选药物。经已完成的全球3期关键试验验证,隆培促生长素为唯一一款,在与短效人生长激素的阳性药物对照及平行组试验比较中,显示出优效性及同等安全性的长效生长激素。
在效果方面,隆培促生长素在治疗病人52周后,病人年生长速率达10.66厘米/年。相比之下,短效(每日注射)人生长激素为9.75厘米/年。
在安全性方面,隆培促生长素也处于领先状态。基于不同技术路径,长效生长激素分为经修饰和未经修饰两大类别。通常认为,未经修饰的人生长激素能更好地实现更接近人体本身生理学的组织分布。隆培促生长素是中国唯一已完成3期临床开发的于每周制剂之间在体内持续释放未经修饰的人生长激素的LAGH。
该未经修饰的人生长激素的分子构成与脑垂体分泌的内源性生长激素相同,并保留了其原始的作用机制。这种疗法不同于中国处于开发阶段及/或已投入商用的其他LAGH疗法,这些LAGH疗法的活性成分为已经过修饰的蛋白或多肽,可能会改变人生长激素效果、药代动力学效果或药效动力学效果、组织渗透和受体结合,并可能对药物疗效及安全性产生不良影响。可以说,维昇药业的这款长效生长激素一旦成功,将大大降低患者使用生长激素的担忧。
除了隆培促生长素,维昇药业另外两条临床管线TransCon CNP和帕罗培特立帕肽,均开创了同类药物的首例。
TransCon CNP是一款处于开发阶段的用于治疗儿童软骨发育不全的潜在同类首创的疾病修正疗法。
TransCon CNP旨在以安全和方便的每周一次给药来优化疗效,是中国迄今为止第一款正在进行临床开发的软骨发育不全疗法。在多项已完成的全球1期临床试验中,TransCon CNP普遍耐受性良好,注射部位反应频次低。目前,TransCon CNP已进入全球2b/3期临床试验,在中国已经进入用于治疗软骨发育不全的2期临床试验,而于2023年1月,维昇药业成为该项试验开放标签阶段的独家申办方。
帕罗培特立帕肽是一款适用于甲状旁腺功能减退症的创新治疗解决方案,也是国内目前唯一一款处于临床阶段的甲状旁腺激素疗法。
甲状旁腺功能减退症目前的疗法因治疗效果有限、需高剂量慢性给药补钙以及相关并发症风险增加而并不充足。帕罗培特立帕肽旨在每天24小时恢复甲状旁腺激素("PTH")的生理水平和活性,从而应对疾病各个方面的问题,包括使血清钙、尿钙以及血磷恢复正常水平。帕罗培特立帕肽的3期关键试验正在进行,已达到主要终点,预计于2024年向国家药监局提交新药上市申请。
目前,维昇药业三款候选药物均使用了Ascendis Pharma开发的暂时连接技术,暂时连接体、暂时连接载体分子和原型药物组成的药物分子进入体内后,能够以可预测的方式释放并保持生理活性,解决其他为延长药物在体内作用时间的方法所面临的基本限制。
产品领先的背后是维昇药业对于研发的重视。其研发团队在创新药物及内分泌疗法的临床开发方面拥有平均超过14年经验。2021年及2022年12月31日止年度各年以及截至2023年5月31日止五个月,维昇药业研发开支分别为人民币2.74亿元、1.80亿元及1.27亿元。具体来看,核心产品隆培促生长素产生的研发成本分别为人民币1.94亿元、1.06亿元及290万元,分别占同期研发成本总额的70.8%、59.1%及22.8%。
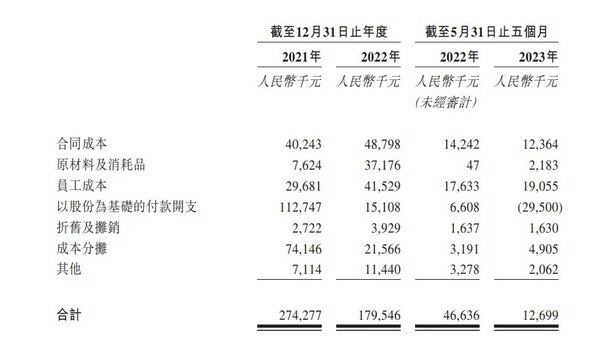
由于进一步的临床研发活动、继续进行候选药物的临床开发并寻求监管批准、将管线产品商业化以及增聘必要人员以经营公司的业务,预期未来几年内,维昇药业仍将持续产生大量开支。
03 中国生长激素市场增速显著,维昇药业亟需迈入商业化
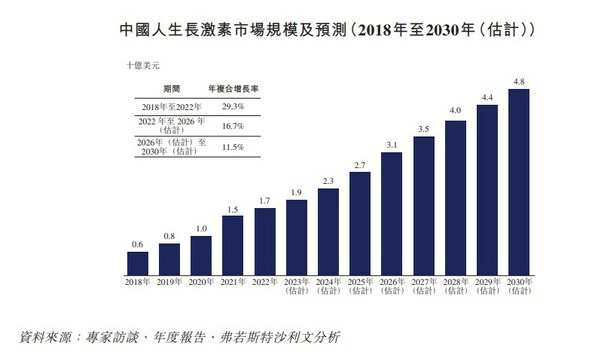
从整体上看,中国人生长激素市场发展迅速。弗若斯特沙利文数据显示,中国人生长激素市场规模由2018年的6亿美元迅速增至2022年的17亿美元,年复合增长率为29.3%;预计到2026年将持续增至31亿美元,自2022年至2026年的年复合增长率为16.7%,并且到2030年将增至48亿美元;自2026年至2030年的年复合增长率为11.5%,增速显著高于美国。同时,中国在全球人生长激素市场占据最大份额,达到34%。尽管中国人生长激素市场规模已经很大,但市场增长潜力依然很高,主要是由于矮小症(如PGHD)的治愈率预计不断上升。
而在维昇药业专注"进攻"的长效生长激素领域,根据弗若斯特沙利文的资料,其市场规模预计将继续大幅增长,并超越短效生长激素疗法市场规模。
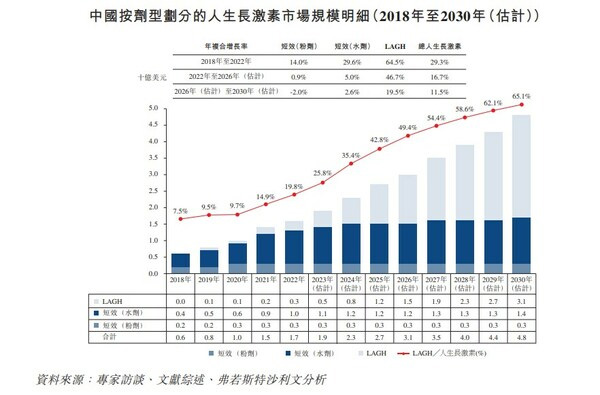
目前,已在中国上市的人生长激素疗法多数为短效粉剂及短效水剂,仅有金赛药业的一款长效生长激素疗法在中国获得上市批准,其他长效生长激素疗法多处于临床开发阶段。
2021年8月28日,丹麦生物制药公司Ascendis Pharma长效产品skytrofa获批在国外上市,该产品技术路线与金赛有所不同。skytrofa也就是维昇药业的核心产品隆培促生长素。也就是说,维昇药业的隆培促生长素若顺利上市,在长效生长素领域将迅速占据一席之地。
目前,维昇药业面临的最大问题即产品尚未实现商业化。以隆培促生长素为例,其于2021年8月获FDA批准及于2022年1月获EMA批准用于治疗PGHD。预计于2023年第四季度向国家药品监督管理局提交生物制剂许可申请(BLA)。
信息来源/美通社
执行主编/尹学兵
值班编辑/七 七
文中图片均获版权方授权


 有任何意见、建议、投稿,欢迎 发送到邮件sjyl1901@163.com
有任何意见、建议、投稿,欢迎 发送到邮件sjyl1901@163.com