世界医疗网(上海)刘平报道 阿尔茨海默病(以下简称AD)给患者及家庭带来了沉重的精神和经济负担。目前全球 AD 患者至少有5000 万,每年新增约 1000 万的 AD病例。我国现有AD 患者数超过千万,占据世界总患者数的五分之一。
面对越来越多的临床需求,过去几十年,研究人员针对AD提出了多个疾病机理假说,但以此为基础的药物开发思路绝大多数以失败告终。近年来,“脑肠轴”机制被发现与AD的核心病理机制相关,逐渐成为了阿尔茨海默病研究领域的热点。
长期以来,国内外学界已证实靶向肠道菌群在治疗阿尔茨海默病上的巨大潜力,而另一方面,其治疗机制尚未得到充分阐明。但是,在国内外阿尔茨海默病研究专家的共同努力下,这一现象逐渐被打破。
5月14-18日,认知障碍症暨脑肠轴巅峰论坛顺利在北京、广州和上海召开,阿尔茨海默病领域知名专家、芝加哥大学神经生物学系分子神经生物学中心主任Sangram S. Sisodia教授(以下简称Sam教授)就“肠道微生物与阿尔茨海默病”为主题展开学术分享,与在场专家一起讨论了脑肠轴在阿尔茨海默病领域的最新学术进展。

Sangram S. Sisodia教授
会上,Sam教授在脑肠轴-β淀粉样蛋白(Aβ)病理研究的基础上,进一步使用甘露特钠胶囊(下称GV-971)研究了肠道菌群紊乱与Aβ斑块沉积之间是通过对中枢神经炎症影响产生密切关联,这些见解也为脑肠轴在其他认知障碍疾病谱系中的临床应用带来极大的鼓舞。
脑肠轴理论在神经退行性疾病中的“机制证据拼图”得到进一步完善
既往的研究表明,肠道菌群和AD的病理生理学之间存在明确的因果关系。
2017年1月,对 AD 患者进行的一项临床试验发现,与无淀粉样蛋白认知障碍组和无疾病对照组相比,淀粉样蛋白阳性组患者的直肠真杆菌和枯草芽孢杆菌丰度较低;并且他们粪便中的大肠杆菌/志贺氏菌丰度更高,这表明了淀粉样蛋白和相关细菌积累在认知障碍中的作用[1]。2022年11月,韩国卫生部支持的一项研究表明,肠道菌群失调会导致AD和轻度认知障碍 (MCI)患者体内的Aβ沉积增加,并提示这可能与炎症有关[2]。2023年1月,华盛顿大学医学院David M. Holtzman教授团队发表的研究表明,肠道菌群失衡可产生影响外周免疫细胞的细菌代谢物,外周免疫细胞受到影响后,进而促进中枢神经系统炎症,导致大脑中Tau聚集和神经退行性变[3],进一步完善了“AD-脑肠轴”的机理证据链。

David M. Holtzman团队研究:Tau病小鼠模型中ApoE亚型和
肠道菌群依赖的神经变性进展[3]
然而,在AD的具体治疗方法中,脑肠轴起到什么作用机制,仍未完全被阐明。在Sam教授本次分享的研究成果中,脑肠轴机制通过GV-971的治疗效用得到了进一步解释。
Sam教授与David M. Holtzman教授主持的这项研究发现,与对照组相比,GV-971可修饰肠道菌群组成,减少Aβ斑块。此外,GV-971还显著降低了小胶质细胞和星形胶质细胞的激活,从而抑制神经炎症发生。这项研究重复并支持了耿美玉教授团队在Cell Research发表的GV-971和脑肠轴的相关治疗机制[4],在证实了靶向脑肠轴可以影响特定菌群及其代谢产物的基础上,还可以抑制神经炎症并降低AD病理标志物沉积,进一步完善了脑肠轴理论在神经退行性疾病中的“机制证据拼图”。
与会专家首都医科大学附属北京天坛医院神经病学中心张巍教授高度肯定了Sam教授的研究成果,他认为:“Sam教授团队的研究再一次证实了脑肠轴紊乱是AD重要的发病机制,靶向脑肠轴可以纠正肠道菌群紊乱,减轻脑内神经免疫炎症,有效清除脑内Aβ,因而靶向脑肠轴进行治疗对AD患者而言是非常有益的。”
四川大学华西医院神经内科主任周东教授也对Sam教授的研究总结道:“Sam教授通过独立的动物实验,验证了GV-971可以通过重塑肠道菌群有效抑制神经炎症和Aβ,并且这与用药剂量和用药时长都密切相关,完善了该药物的证据链,进一步证实了脑肠轴在AD发病中的重要作用。”
脑肠轴——一切认知交汇处,这一共性机制将在更多认知障碍疾病中展现治疗潜力
随着社会环境的快速变化,比如老龄化以及新冠病毒大流行的公共卫生危机,精神障碍疾病和认知障碍疾病的流行风险正在快速增加,而相关疾病的成病机制复杂,单一靶点所衍生的治疗思路能够带来的临床收益相当有限,以阿尔茨海默病为代表的认知障碍疾病治疗观正在向多靶点的整体性治疗观转变。
因此,参与到多个阿尔茨海默病机制的“脑肠轴”通路,近十几年来逐渐受到学界和业界的重视。
世界卫生组织把健康定义为是“身体、心理、社会环境一体”,而脑肠轴机制正是这三者交互影响中的桥梁。因此,脑肠轴越来越被认为是众多认知疾病的共性机制,2017年发表在Nature上的一篇文章指出:“肠道菌群的组成与许多疾病之间存在关联,因此肠道菌群可能是体内一切(健康问题)的交汇处?”[5],同时2021年发表在Science上的一篇文章也指出:“肠道微生物群积极参与人体生理的各个方面,且与多种神经退行性疾病有密切关联[6]。”
在AD临床研究中,除了Aβ和Tau之外,神经炎症、代谢紊乱、线粒体损伤、氧化应激都被发现与脑肠轴密切相关,而这些机制也广泛参与到其他的认知障碍疾病和基础慢性疾病之中,比如帕金森病、肥胖、糖尿病认知障碍、卒中后认知障碍等等[7]。
对于靶向脑肠轴的治疗潜力,北京协和医院神经内科主任李延峰教授在会上表示:“不仅仅是阿尔茨海默病,现在有很多神经变性病像帕金森病和运动神经元病都跟肠道菌群、炎症密切相关,脑肠轴与这些疾病进展的密切关联也得到学界的主流意见来应证。”
与会专家浙大医学院附属浙江医院陈怀红主任也认为:“ 近10余年来已经大量的文献都表明,肠道微生物影响着很多疾病,尤其是老年慢性疾病的发生、发展,微生物和我们共息共存。近年来一系列的研究都提示,肠道菌群会影响到我们大脑的健康,许多的肠道微生物,它会影响到我们一些神经递质的产生与释放,由此就参与了许多神经变性病的疾病发生,今后脑肠轴的证据也会越来越多,越来越完善。”
脑肠轴机制不仅在学术界受到肯定,其治疗效果也在临床上不断被证实,在Sam教授研究中涉及的脑肠轴机制药物GV-971,近几年来在包括AD在内的多种认知障碍疾病中展现出了较好的疗效[8][9]。《柳叶刀》上发表的一篇文章曾把GV-971定位为‘靶向神经炎症的疾病修饰类阿尔茨海默病治疗药物’[10],表明靶向脑肠轴不仅可以对症,还能够延缓甚至逆转认知疾病的疾病进展。
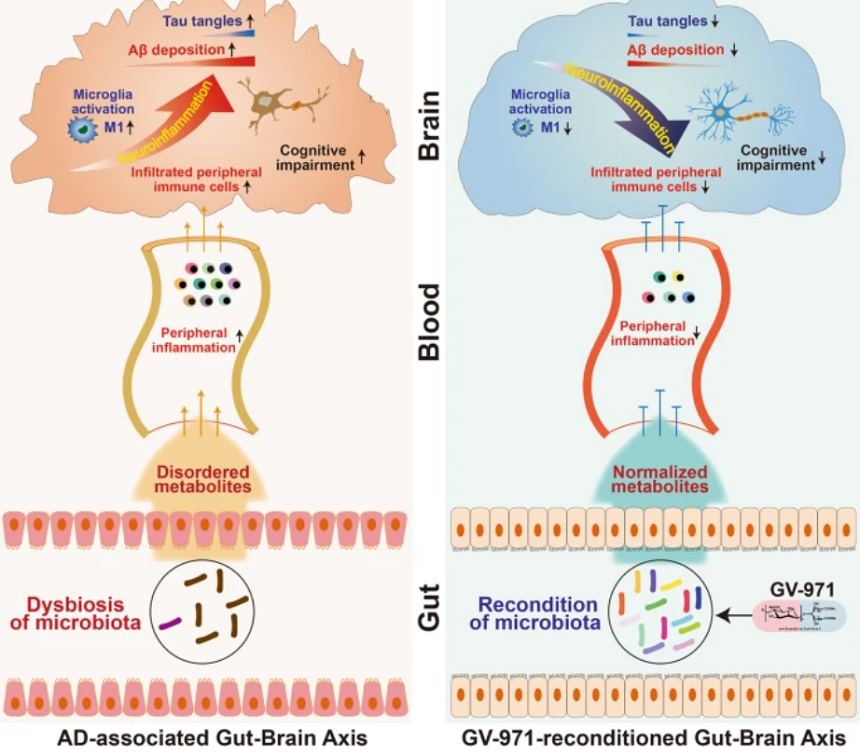
GV-971机制示意图[4]
随着脑肠轴理论在疾病中的“共性机制”不断得到来自学界和临床上的认可,GV-971陆续被纳入涉及多个认知障碍治疗的专家共识和指南,比如《阿尔茨海默病诊疗规范(2020年版)》、《精神障碍诊疗规范(2020 年版)》、《2型糖尿病患者认知功能障碍防治的中国专家共识2022》、《额颞叶变性诊治中国专家共识2022》等等。
Sam教授在会上表示:“肠道菌群是否能够带来脑科学的重大变化,我认为答案是肯定的,(以前)我们总是会关注大脑本身,但我认为我们现在是进入到一个新的时代,因为脑肠轴对认知的影响将引领新一轮的脑科学革命。”在不久的将来,随着复杂慢病的治疗策略逐渐迈入“以整体治疗观为主”的新时代,靶向脑肠轴的相关疗法将有望在更多的认知障碍疾病上发挥积极的治疗作用。
1.Cattaneo A, Cattane N, Galluzzi S, et al. Association of brain amyloidosis with pro-inflammatory gut bacterial taxa and peripheral inflammation markers in cognitively impaired elderly[J]. Neurobiology of aging, 2017, 49: 60-68.
2.Jung J H, Kim G, Byun M S, et al. Gut microbiome alterations in preclinical Alzheimer’s disease[J]. Plos one, 2022, 17(11): e0278276.
3.Seo D, O’Donnell D, Jain N, et al. ApoE isoform–and microbiota-dependent progression of neurodegeneration in a mouse model of tauopathy[J]. Science, 2023, 379(6628): eadd1236.
4.Wang X, Sun G, Feng T, et al. Sodium oligomannate therapeutically remodels gut microbiota and suppresses gut bacterial amino acids-shaped neuroinflammation to inhibit Alzheimer’s disease progression[J]. Cell research, 2019, 29(10): 787-803.
5.Cani P D. Gut microbiota—at the intersection of everything?[J]. Nature Reviews Gastroenterology & Hepatology, 2017, 14(6): 321-322.
6.Seo D O, Holtzman D M. Gut microbiota: from the forgotten organ to a potential key player in the pathology of Alzheimer’s disease[J]. The Journals of Gerontology: Series A, 2020, 75(7): 1232-1241.
7.Mou Y, Du Y, Zhou L, et al. Gut microbiota interact with the brain through systemic chronic inflammation: Implications on neuroinflammation, neurodegeneration, and aging[J]. Frontiers in immunology, 2022: 1046.
8.Wang YL, Zhang Y, Xu J. Sodium oligomannate combined with rivastigmine may improve cerebral blood flow and cognitive impairment following CAR-T cell therapy: A case report. Front Oncol. 2022 Aug 18;12:902301.
9.房立岩, 尤丰玲, 曹丽平,等. 甘露特钠联合美金刚和多奈哌齐治疗混合型痴呆1例. 国际老年医学杂志. 2022,43(06): 772-775.
10.Scheltens P, De Strooper B, Kivipelto M, et al. Alzheimer's disease[J]. The Lancet, 2021, 397(10284): 1577-1590.
消息来源/阿来灯认知健康
执行主编/尹学兵
值班编辑/李 晓


 有任何意见、建议、投稿,欢迎 发送到邮件sjyl1901@163.com
有任何意见、建议、投稿,欢迎 发送到邮件sjyl1901@163.com